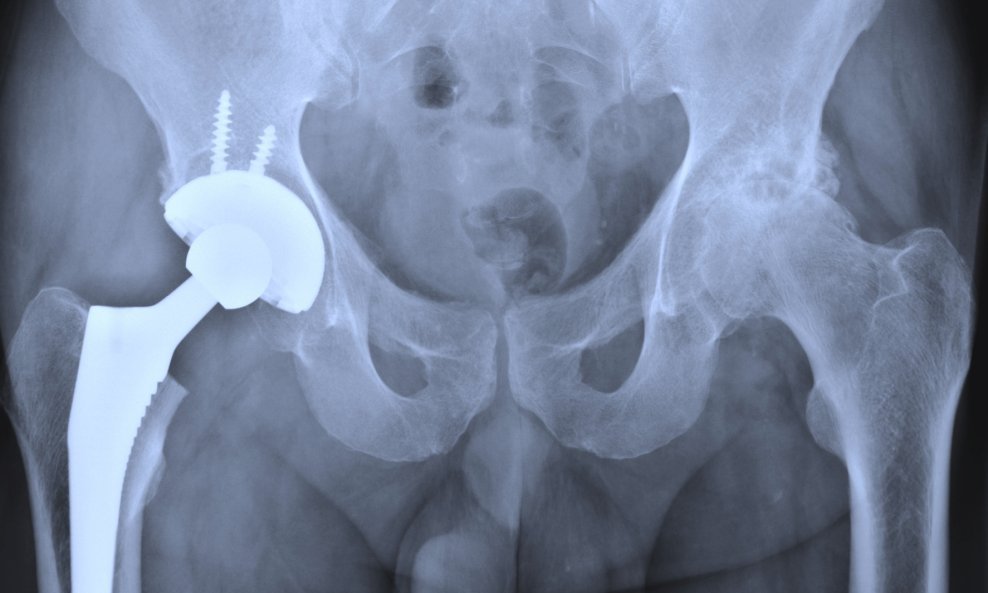
Nedavno je u javnost dospjela informacija kako je zdravlje britanskih pacijenata izloženo riziku zbog 'beskrupuloznih europskih regulatora koji su spremni licencirati potencijalno opasne medicinske implantate za prodaju', što je otkrio britanski Telegraph u zajedničkoj istrazi s British Medical Journalom (BMJ), u kojoj su pronašli niz rupa u sustavu EU-a koji odobrava medicinske proizvode, uključujući umjetne kukove, koljena i druge zglobove. Na koji način se provodi certificiranje medicinskih proizvoda koji dolaze na hrvatsko tržište, za tportal je objasnila Agencija za lijekove i medicinske proizvode (HALMED) koja je zadužena za njihovo odobravanje
'Medicinski proizvodi moraju biti sigurni za korisnike i korist njihove primjene mora biti veća od eventualnih rizika te stoga HALMED provodi iznimno strog nadzor nad medicinskim proizvodima prije i nakon njihova stavljanja na tržište. Također, HALMED o svim sigurnosnim informacijama o medicinskim proizvodima koji su dostupni hrvatskim pacijentima obavještava javnost te daje preporuke o njihovoj uporabi', kazali su za tportal iz Agencije za lijekove i medicinske proizvode (HALMED).
Usklađenost s europskim sustavom odobravanja medicinskih proizvoda
Pripremajući se za ulazak u Europsku uniju, prema riječima HALMED-a, Hrvatska se uskladila s europskim sustavom odobravanja medicinskih proizvoda koji se temelji na direktivama koje uređuju područje medicinskih proizvoda, in vitro dijagnostičkih medicinskih proizvoda te aktivnih medicinskih proizvoda za ugradnju. Prije stavljanja u promet u Europskoj uniji, svi medicinski proizvodi trebaju dobiti ocjenu sukladnosti koju dodjeljuju tijela za ocjenu sukladnosti i potom odobrenje nadležnog regulatornog tijela.
'Tijela za ocjenu sukladnosti su tijela akreditirana, nadzirana i kontrolirana od strane nacionalnih regulatornih tijela, najčešće ministarstava nadležnih za zdravstvo. Nakon što zadovolje sve stroge kriterije i od nadležnog tijela dobiju potrebnu dozvolu, odnosno akreditaciju, moraju se još i prijaviti Europskoj komisiji, od koje dobivaju svoj jedinstveni identifikacijski broj i tek tada postaju 'prijavljena tijela' (eng. Notified Bodies) te dobivaju pravo obavljanja djelatnosti certificiranja medicinskih proizvoda na području Europske unije. Trenutno je u EU-u prijavljeno 77 tijela za ocjenu sukladnosti medicinskih proizvoda, 20 za aktivne medicinske proizvode za ugradnju te 26 za in vitro dijagnostičke medicinske proizvode', detaljno su objasnili iz HALMED-a.
No koje kriterije je potrebno zadovoljiti da bi medicinski proizvodi dobili ocjenu sukladnosti?
'Medicinski proizvodi moraju prethodno ispuniti sve iznimno stroge sigurnosne i tehničke zahtjeve, proći sva potrebna klinička ispitivanja, ispuniti sve zahtjeve vezane uz proizvodnju, tehnički dizajn i sastav proizvoda sukladno njihovoj namjeni, uspješno proći ispitivanja biokompatibilnosti te dokazano biti sigurni za uporabu. Nakon ocjene sukladnosti, proizvođač sastavlja izjavu o sukladnosti kojom preuzima odgovornost za sukladnost medicinskog proizvoda te time ispunjava sve uvjete za isticanje oznake sukladnosti CE na samom proizvodu. Samo proizvodi s tom oznakom smiju se nalaziti u prometu na području Europske unije. Međutim, posljednju odluku u odobravanju medicinskog proizvoda ima nacionalno regulatorno tijelo. Dakle, u Republici Hrvatskoj krajnju ocjenu i registraciju medicinskog proizvoda provodi HALMED, pri čemu razmatra dokumente o sukladnosti i oznaku sukladnosti koju je dalo nadležno prijavljeno tijelo države članice Europske unije. HALMED kao nacionalno regulatorno tijelo u slučaju sumnje na bilo kakvu nepravilnost i u svrhu zaštite zdravlja pacijenata može zaustaviti stavljanje medicinskog proizvoda na hrvatsko tržište', kazali su nam iz HALMED-a.
HALMED: Zdravlje britanskih pacijenata nije bilo ugroženo
U spomenutom članku objavljenom u britanskom listu The Daily Telegraph, implantat koji je dizajniran za potrebe istrage nije došao u fazu ocjene sukladnosti. Odnosno, objašnjavaju iz HALMED-a, predstavnici proizvođača, to jest, u ovom slučaju novinari, i predstavnici prijavljenog tijela održali su tek preliminarni razgovor, i to uz nepotpune podatke o proizvodu.
'Prijavljenom tijelu nije dostavljena potrebna opsežna tehnička dokumentacija, zbog čega postupak ocjene sukladnosti za medicinski proizvod nije mogao niti započeti. Na tom sastanku novinari su općenito informirani o troškovima i tijeku postupka ocjene sukladnosti, a to su pogrešno shvatili kao voljnost da bi njihov proizvod mogao dobiti oznaku sukladnosti. Naime, tijela za ocjenu sukladnosti imaju zakonsku obvezu održati preliminarni sastanak sa svakim podnositeljem zahtjeva koji to zatraži i pritom ga detaljno informirati o postupku ocjene sukladnosti', kazali su iz Agencije i ponovili kako postupak ocjene sukladnosti za konkretni proizvod nije još bio ni započeo.
'S obzirom na vrstu medicinskog proizvoda, postupak ocjene sukladnosti bi obavezno, uz sveobuhvatnu kontrolu kakvoće vezanu uz proizvod i proizvodnju, uključio i kontrolu samog dizajna proizvoda. Budući da je upravo odlika dizajna prouzrokovala probleme s endoprotezama kuka povučenim s tržišta 2010. godine, sigurni smo da bi tijelo za ocjenu sukladnosti uočilo neispravnost proizvoda. U suprotnom, ako kojim slučajem tijelo za ocjenu sukladnosti ne bi uočilo neispravnost proizvoda, reagirala bi ostala regulatorna tijela koja bi spriječila dolazak takvog proizvoda na tržište, a u navedeno tijelo za ocjenu sukladnosti stigla bi žurna inspekcija koja bi preispitala njegovu akreditaciju za daljnje obavljanje djelatnosti certificiranja medicinskih proizvoda', izjavili su iz HALMED-a.
Agencija je naglasila kako poduzima sve potrebne mjere kako bi se zaštitilo zdravlje i sigurnost hrvatskih pacijenata te provodi iznimno strog nadzor nad medicinskim proizvodima prije i nakon njihova stavljanja na tržište kako bi se osigurala dostupnost medicinskih proizvoda koji su sigurni za korisnike i čije su dobrobiti primjene veće od eventualnih rizika.